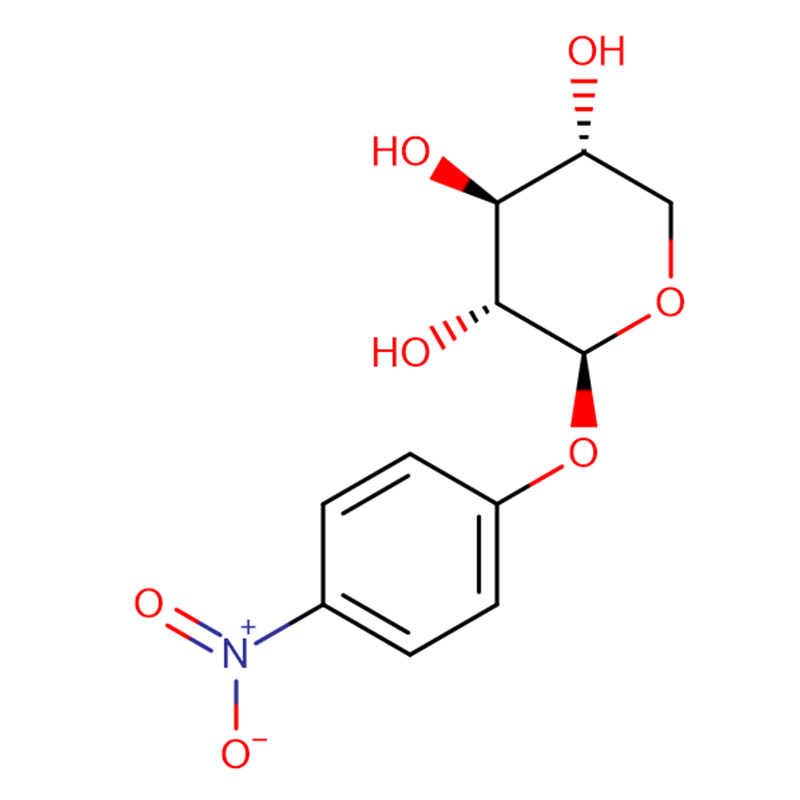
Biosyntéza proteoglykánov a glykozaminoglykánov v prítomnosti p-nitrofenyl-xylozidu bola študovaná s použitím primárneho potkanieho ovariálneho granulózneho bunkového kultivačného systému.Pridanie p-nitrofenyl-xylozidu do bunkového kultivačného média spôsobilo približne 700 % zvýšenie inkorporácie [35S]sulfátu (ED50 pri 0,03 mM) do makromolekúl, ktoré zahŕňali voľné chondroitínsulfátové reťazce iniciované na xylozide a natívnych proteoglykánoch.Voľné chondroitín sulfátové reťazce iniciované na xylozide boli takmer výlučne vylučované do média.Molekulová veľkosť reťazcov chondroitín sulfátu sa znížila zo 40 000 na 21 000, keď sa zvýšila celková inkorporácia [35S]sulfátu, čo naznačuje, že zvýšená syntéza chondroitín sulfátu narušila normálny mechanizmus ukončenia glykozaminoglykánového reťazca.Biosyntéza proteoglykánov heparansulfátu sa znížila približne o 50 %, pravdepodobne v dôsledku konkurencie na úrovni prekurzorov cukru UDP.Inkorporácia [35S]sulfátu bola zastavená pridaním cykloheximidu s počiatočným polčasom približne 2 hodiny v prítomnosti xylozidu, zatiaľ čo v neprítomnosti xylozidu to bolo približne 20 minút.Rozdiel pravdepodobne odráža rýchlosť obratu kapacity syntetizujúcej glykozaminoglykány ako celku.Rýchlosť obratu kapacity syntetizujúcej glykozaminoglykán pozorovaná v granulózových bunkách vaječníkov bola oveľa kratšia ako rýchlosť pozorovaná v chondrocytoch, čo odrážalo relatívnu dominanciu proteoglykánovej biosyntetickej aktivity v celkovej metabolickej aktivite buniek.